Qualche giorno fa ho appreso da Wikipedia che IUPAC e IUPAP (organizzazione, quest’ultima, di cui ignoravo l’esistenza) hanno definitivamente approvato i nomi di darmstadtio, roentgenio e copernicio per gli elementi di numero atomico da 110 a 112. Tutti e tre sono stati sintetizzati per la prima volta intorno alla metà degli anni ’90 al GSI di Darmstadt, il che spiega i nomi «teutonici» a loro attribuiti. Se volete stare al passo coi tempi vi conviene quindi mettere subito mano alla vostra tavola periodica (ogni geek che si rispetti ne ha almeno una in casa) e aggiornare le caselline corrispondenti nell’ultima riga!
A tal proposito, ricordo che ai miei tempi (cioè quando facevo le superiori) le tavole periodiche di solito finivano con i primi due transattinidi, ovvero gli elementi 104 e 105, che erano chiamati rispettivamente rutherfordio e hahnio, e sui libri c’era scritto che questi due elementi erano stati scoperti nel 1969 e nel 1970 da un team di fisici nucleari operante all’Università di Berkeley guidato dal leggendario Glenn Seaborg e dal suo allievo Albert Ghiorso (cognome di chiarissime origini italiane, e anzi azzarderei liguri). Ma le cose non stavano proprio così, o meglio quella scritta sui libri non era tutta la verità: i medesimi elementi erano infatti stati ottenuti circa tre anni prima anche dal team avversario di quello di Seaborg, operante al JINR di Dubna, nell’allora Unione Sovietica. Considerato che in quel periodo si era in piena guerra fredda, non è difficile immaginare come siano andate le cose: ciascuno dei due gruppi si rifiutò di riconoscere la scoperta dell’altro e l’attribuzione di un nome ai due nuovi elementi divenne un caso diplomatico. I Paesi del blocco occidentale (tra cui l’Italia, e quindi i miei libri di testo) adottarono i nomi sopra ricordati, proposti dagli americani; i Paesi del blocco sovietico optarono invece per i nomi di kurchatovio e nielsbohrio. (Sicuramente non aiutò a raffreddare gli animi il fatto che quell’Igor Kurchatov al quale i sovietici volevano intitolare l’elemento 104 fosse stato il direttore del progetto che portò l’URSS a ottenere la bomba nucleare nel 1949.) La controversia sarà risolta solo nel 1997 (quindi ben dopo il collasso dell’Unione Sovietica), quando finalmente viene trovato un compromesso che mette d’accordo tutti: così oggi l’elemento 104 ha mantenuto la denominazione “occidentale” di rutherfordio, mentre l’elemento 105 viene chiamato dubnio a parziale riconoscimento del ruolo svolto dai ricercatori del laboratorio sovietico. (In tutto ciò, il povero Otto Hahn è purtroppo rimasto «senza sedia», il che è un vero peccato viste le qualità morali dell’individuo, che vi invito ad approfondire visitando il link precedente.)
Ma non era di tali frivolezze che volevo parlare oggi, bensì proprio di questo vecchio arnese:
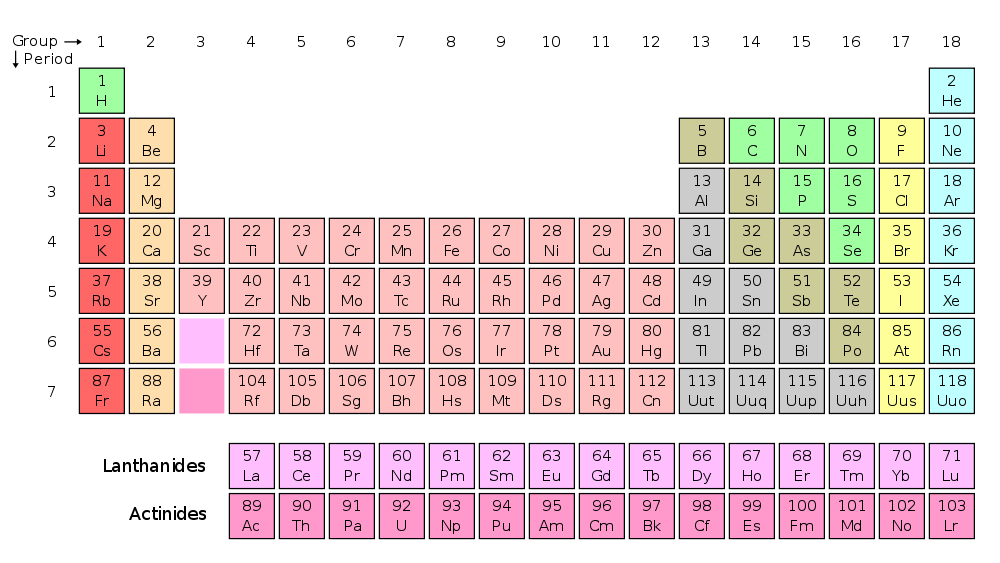
L’avete riconosciuta? È proprio lei, la tavola periodica, così come è stata proposta inizialmente da Dmitri Mendeleev nel 1869 (anche se l’idea in sé non era del tutto nuova). Naturalmente all’epoca molti elementi erano ancora sconosciuti ma il principio fondamentale, cioè quello di elencare gli elementi in ordine di peso atomico crescente mettendo uno di fianco all’altro quelli chimicamente affini, è già ben chiaro. La gran parte dei buchi verrà riempita nel periodo tra la fine del diciannovesimo e l’inizio del ventesimo secolo, e grazie all’opera di numerosi altri fisici la tavola periodica assumerà infine la forma che oggi ci è più familiare:
Familiare, ma fino a che punto corretta? Secondo alcuni, come ad esempio John Denker, ci sono ottime ragioni per ritenere fuorviante il classico layout “a blocchi” della tavola periodica, perché in tale rappresentazione alla somiglianza tra elementi non corrisponde sempre la vicinanza delle rispettive caselle. Ad esempio, elementi affini come calcio e zinco si trovano molto lontani tra loro perché devono “fare spazio” ai restanti metalli di transizione. Lo stesso problema, ancora più accentuato, si riscontra con lantanio e lutezio, che pur essendo chimicamente simili si trovano ai capi opposti della serie dei lantanidi.
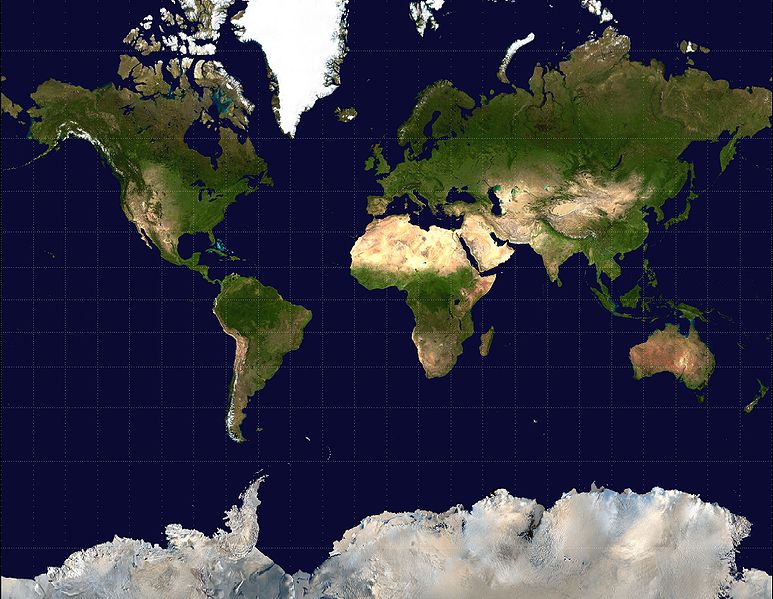
Il rimedio proposto da Denker è molto semplice: se vogliamo avere una rappresentazione più fedele dell’affinità tra i vari elementi occorre abbandonare le tavole bidimensionali e costruirne una in tre dimensioni! Per capire il senso di un simile suggerimento può essere utile la seguente analogia. Come immagino sappiate, è impossibile rappresentare la superficie di una sfera su un piano in maniera tale da preservare le distanze e gli angoli (e magari un giorno parleremo anche del perché ciò accade). Ciò comporta che ogni mappa della superficie terrestre debba necessariamente introdurre discontinuità e distorsioni, come avviene ad esempio nella celebre proiezione di Mercatore, che rende le zone vicino ai poli più grandi di quanto in realtà non siano:
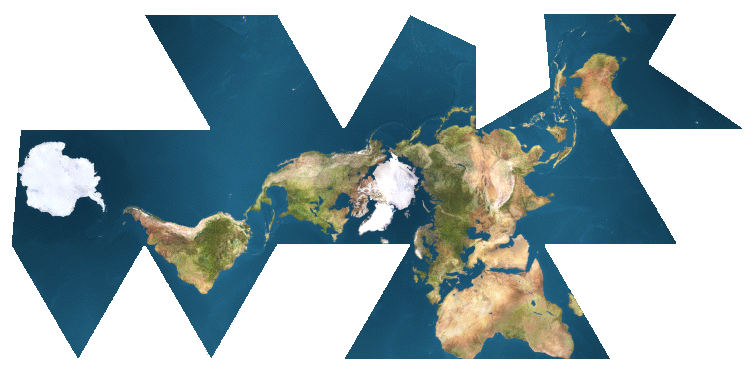
o nella meno celebre proiezione di Fuller, che resta più fedele alla reale forma dei continenti al prezzo di introdurre dei tagli arbitrari:
Allo stesso modo i difetti della rappresentazione “standard” della tavola periodica accennati in precedenza possono essere interpretati come una conseguenza del fatto che stiamo cercando di disegnare su un piano un oggetto la cui geometria intrinseca non è piatta.
Seguendo fino in fondo questa idea, Denker ha costruito una tavola periodica che lui stesso definisce a forma di «cilindro con rigonfiamenti» (mentre Wikipedia la definisce, più poeticamente, «a forma di fiore»); qui di seguito ne trovate una visuale, e sul suo sito ci sono le altre (e le istruzioni per costruirne una):
Notate come calcio e zinco siano ora fisicamente vicini (be’, lo zinco ve lo dovete immaginare ma c’è, sull’altro lato del foglio) e, oltretutto, entrambi collocati “sotto” (in un certo senso) al magnesio, di cui condividono le proprietà chimiche. Stesso discorso (e questo sì che si vede bene dalla foto qui sopra) per lantanio e lutezio, che ora si trovano vicini tra loro ed entrambi direttamente sotto all’ittrio, loro parente stretto.
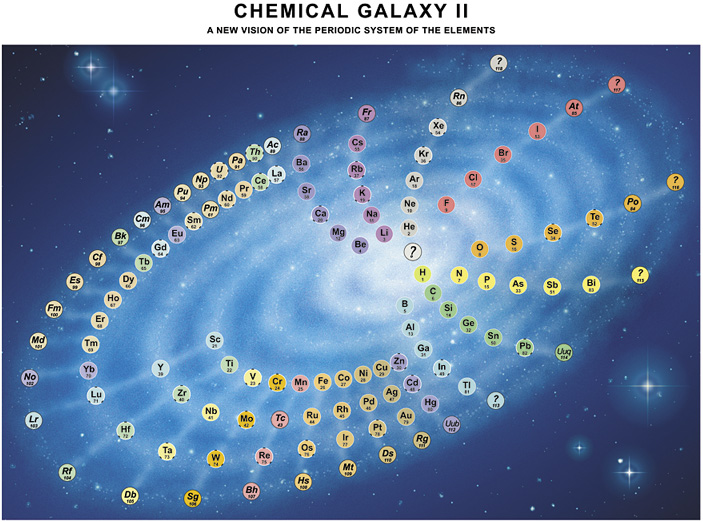
Quello di Denker non è comunque l’unico layout non-standard della tavola periodica. Un altro che trovo particolarmente carino è quello a forma di galassia ideato da Philip Stewart, in cui la progressione dei numeri atomici forma una spirale e gli elementi chimicamente affini formano i «bracci» della galassia:
ma c’è veramente l’imbarazzo della scelta, come testimoniano le centinaia di tavole periodiche che potete trovare in questo database online. Senza contare, ovviamente, l’upgrade più radicale di tutti: quello da immagine statica a tavola interattiva.


Eric Scerri, il maggior esperto del settore (e autore dello splendido “The periodic table” che al momento non ha ancora trovato un editore italiano, oltre al più recente “A very short introduction to PT”) durante l’estate ha animato un intenso dibattito su quale sia la forma preferibile, tenendo presente che ovviamente non si tratta di rappresentare un oggetto bidimensionale e tantomeno dotato di metrica euclidea. Lo trovate qui http://t.co/vGUq3Szk
Sergio Palazzi
Interessante! Grazie per la segnalazione 🙂
Like
(facebook mode on)
copernico non e` un po’ passatello per dedicargli un elemento? e soprattutto, a lui fregava qualcosa della composizione della materia?
La motivazione, che personalmente condivido, offerta da Sigurd Hofmann (uno degli “scopritori”), è quella di rendere merito ad uno scienziato autorevole che non ha mai ricevuto alcun riconoscimento durante la sua vita, e mettere in evidenza il legame tra l’astronomia e il campo della chimica nucleare.
http://www.iupac.org/web/nt/2010-02-20_112_Copernicium
Ma come! Tu quoque Albertus??? Mi scrivi un articolo di chimica ??? 🙂
Scherzi a parte, è interessante come sempre.
Adesso attendo con ansia il post su Iguazù…
Complimenti per il blog, l’ho trovato veramente interessante sia come contenuti che come modo di presentarli…
Magari chi lo sa, un giorno avrò anchio il tempo per dedicarmi a un blog riguardo alla mia passione, la fisica!
Blog così meriterebbero un bel posto in prima fila tra quelli visitati, altro che quelli dei vip 🙂
Be’, che dire… grazie mille! 🙂
Hai toccato il tasto dolente: anch’io avrei idee per un numero molto maggiore di post di quelli che riesco effettivamente a scrivere, il problema è riuscire a trovare il tempo da dedicarci… 🙁